Introduction
Edité par le Dr Gianfranco De Angelis
Le terme "protéine" est désormais répandu partout et partout où l'on entend parler de compléments protéinés, de poudres protéinées, de barres protéinées, de boissons protéinées etc. Cependant, peu connaissent sa véritable signification.
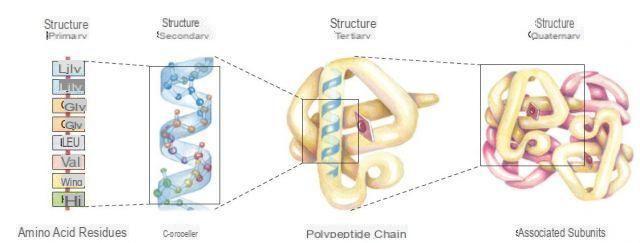
Je vais donc essayer d'expliquer ce que sont les protéines non pas d'un point de vue biochimique, mais en mettant en évidence leur type de structure et leur relative classe.
classification
Classification des protéines
- Basé sur la fonction réalisée : enzymes, hormones, transport, stockage et protéines structurelles ;
- Selon la forme : protéines fibreuses ou globulaires ;
- Sur une base chimique :
- protéines simples : composées uniquement d'acides aminés
- protéines composées ou conjuguées : elles sont liées à d'autres molécules (ex. sucres, lipides, acides nucléiques, métaux, etc.).
simple
Il existe deux classes de protéines simples : fibreuses et globulaires. La subdivision est basée sur la nature des acides aminés obtenus avec l'hydrolyse des protéines, leur classification est donc basée sur les concepts de solubilité et de composition chimique.
Les protéines simples donnent lieu à huit groupes de subdivisions : les protamines, les histones, les albumines, les globulines, les glutélines, les prolamines, les phosphoprotides et les scléroprotides.
Protamine
Le protamine ce sont des protéines assez simples, car, par clivage, elles ne donnent naissance qu'à quelques types d'acides aminés : principalement l'arginine et la lysine. Ils ont donc un faible poids moléculaire.
Solubles dans l'eau, à caractère fortement basique, les protamines ne se trouvent dans la nature que dans le règne animal, associées à des acides nucléiques pour former des nucléoprotides (notamment dans les tissus à fonction reproductrice, par exemple dans les spermatozoïdes de nombreux poissons). On ne les trouve pas libres dans la nature
Les protamines sont exemptes d'acides aminés soufrés, de tryptophane et de tyrosine ; au contraire, ils sont très riches en acides aminés basiques (en particulier l'arginine).
Istoni
Les istoni ce sont des protides assez simples, même si plus complexes que les protamines ; comme ces derniers, les histones n'appartiennent qu'au règne animal, ont un caractère basique et sont solubles dans l'eau ; ils se distinguent au contraire pour contenir du soufre et pour produire de plus petites quantités de bases exoniques dans le clivage (arginine, histidine et lysine), dont ils sont pourtant riches.
Comme les protamines, les histones ne se trouvent pas libres dans la nature, mais combinées avec d'autres substances pour former des protides. On les trouve dans les globules rouges, dans les leucocytes, dans les têtes des spermatozoïdes ; la globine, qui constitue le groupe protéique de l'hémoglobine, est importante.
Albumine
Le albumines ce sont les protéines les plus connues et les plus facilement accessibles ; étant très répandus, ils ont donné leur nom à toute la classe des substances protéiques (substances albumoïdes). Dans le règne animal, ils sont répandus et principalement associés aux globulines, en tant que constituants des cellules et des sécrétions cellulaires. Certaines de leurs propriétés caractéristiques sont : la solubilité dans l'eau, la coagulabilité à la chaleur et la possibilité de donner naissance à tous les acides aminés par division (ce sont donc des protéines complètes de bonne valeur biologique). Ils ont une teneur élevée en leucine (environ 10-14%) et en acide glutamique (7-13%); ils contiennent également de bonnes quantités d'arginine (6-10%) et de lysine (6-8%).
Les principales albumines animales sont : l'ovalbumine (ou albumine d'œuf) et l'albumine de lactosérum (ou albumine de lait). On les retrouve également dans de nombreuses plantes, bien que leurs propriétés ne soient pas parfaitement connues. Une caractéristique de l'albumine animale est d'avoir une teneur élevée en soufre, et un pourcentage considérable d'acides aminés cystine et méthionine, tandis que les végétaux en contiennent des quantités modestes. Certaines albumines végétales sont toxiques; c'est le cas de la ricine dans l'huile de ricin.
Globuline
Le globulines ce sont les protéines les plus courantes, aussi bien dans le règne animal que végétal. Elles sont très semblables, au point de vue de la constitution moléculaire, aux albumines, mais elles diffèrent par la taille. De plus, alors que l'albumine se dissout dans l'eau, les globulines sont non polaires ; par contre ils sont solubles dans les solutions salines diluées neutres (NaCl). Les plus courantes sont : les globulines sanguines (α β, γ), la lactoglobuline (lait), l'ovoglobuline (œufs), la myosine et la myoglobine (muscle). Les globulines végétales se trouvent notamment dans les graines de nombreuses plantes, notamment dans les huiles de légumineuses ; très riches en globulines sont les protéines du soja et des arachides, où elles forment la quasi-totalité des substances protéiques. Alors que les globulines animales ne présentent pas de carences majeures en acides aminés, celles du monde végétal sont gravement carencées en méthionine (sans surprise, l'acide aminé limitant du soja et d'autres légumineuses).
Le Gluteline et prolamine (ou gliadines) représentent deux groupes de protéines exclusivement végétales, typiquement associées. Ensemble, ils constituent le plus grand pourcentage de la réserve protéique des céréales (90-95%).
Gluteline
Le glutéline ils ont un bon équilibre en acides aminés et sont très riches en acide glutamique, cependant présents à des concentrations plus faibles que les prolamines. Ils sont insolubles dans l'eau, dans les solutions salines et dans l'alcool ; ils coagulent à la chaleur et sont solubles dans les acides et les bases dilués. La gluteline de blé, appelée gluténine, forme un complexe protéique avec la gliadine qui constitue le gluten, indispensable à la panification et en partie à la plastification des farines. Dans le riz, la gluteline présente est appelée orizenine.
Prolammine ou Gliadine
Le prolamine ils contiennent, en quantité considérable, l'acide aminé proline, dont dérive le nom. Ils n'appartiennent qu'au règne végétal, en fait, avec la gluteline, ils constituent la partie la plus importante de nombreuses céréales, dont ils sont facilement extraits. On les appelle aussi gliadines.
Les gliadines les plus connues sont : gliadine le blé, qui a donné son nom à toute la classe : l'ordre de l'orge ; la zein du maïs. Ils sont insolubles dans l'eau et solubles dans l'alcool à 60-80%. Ils ne coagulent pas à la chaleur.
Les prolamines sont riches en acide glutamique, qui représente 20-30% des acides aminés des graines de céréales ; la proline et la leucine sont également abondantes, tandis que les acides aminés soufrés, la lysine (qui est sans surprise l'acide aminé limitant typique des céréales) et le tryptophane (déficient en maïs) sont rares. Ces carences en acides aminés sont responsables de la faible efficacité protéique des céréales. L'intolérance congénitale à la gliadine est connue sous le nom de maladie cœliaque.
Phosphoprotéines
I phosphoprotéines ce sont des protéines particulièrement riches en acide phosphorique, donc riches en phosphore sous forme d'acide ortho-phosphorique, liées pour estérifier le groupement alcoolique des acides aminés (comme la sérine). Ils ont des propriétés acides dues aux hydrogènes de l'acide phosphorique qui ne participe pas à l'estérification. Les phosphoprotéines ne doivent pas être considérées comme des protéines conjuguées, ni être confondues avec des nucléoprotéines, capables d'hydrolyser l'acide phosphorique. Les phosphoprotides sont principalement présents dans les protéines d'origine animale, où l'on trouve deux représentants importants : les caséines de lait et le jaune du jaune d'œuf (la vitelline est l'une des substances fondamentales du jaune et est une protéine particulièrement riche en phosphore). On se souvient également de l'ittuline des œufs de poisson. Les principaux constituants de ces protéines sont l'acide glutamique (15-20%), la sérine (qui regorge principalement de protéines d'œuf), la proline (5-10%) et la lysine (5-7%). En revanche, la cystine est rare.
Scléroprotides
Les scléroprotide (o scléroprotéine) sont aussi appelés albuminoïdes ou protéinoïdes et appartiennent insaisissable au règne animal. Contrairement aux protéines mentionnées ci-dessus, elles ne font pas partie du protoplasme. Ce sont des substances avec une résistance chimique considérable, insolubles dans l'eau et les solvants courants, qui ne se dissolvent que dans les acides et résistent même à la plupart des enzymes protéolytiques. De par leur résistance chimique exceptionnelle, ils remplissent des fonctions mécaniques d'enrobage, de protection et de support, alors qu'ils ont une faible valeur nutritionnelle. Les scléroprotides les plus importants dans les organismes animaux sont : le collagène (constituant fondamental du tissu conjonctif, cartilagineux et osseux), l'élastine (constituant de base des fibres élastiques des tendons et des parois des vaisseaux) et les kératines (constituants des ongles, des cheveux et des cheveux, mais aussi des squames , cornes et plumes). Les scléropeptides sont composés de peu d'acides aminés : la cystine (donc le soufre) abonde en kératine, tandis que le collagène est riche en glycine (25%), proline et hydroxyproline, et déficient en sulfurates, tryptophane et tyrosine. La glycine et la leucine sont abondantes dans l'élastine, tandis que la cystine est rare. La kératine n'est pas attaquable par les sucs gastriques, donc la digestibilité et l'absorption intestinale sont très faibles ; il tire une importance rare dans l'alimentation. Faire bouillir du collagène avec des acides dilués augmente sa digestibilité en le transformant en gélatine.
Protéines conjuguées
Après un bref aperçu des huit groupes qui subdivisent les protéines simples, il est nécessaire de parler, quoique brièvement, de la deuxième classe de protéines, à savoir les protéines conjuguées. Ils consistent en une simple protide chimiquement liée à un groupe non protéique appelé prothèses. Les groupes prothétiques sont des substances organiques naturelles qui agissent comme des cofacteurs enzymatiques (auxiliaires). La partie protéique simple est généralement une protéine du groupe des histones ou de la protamine. Le groupe prothétique, en revanche, est variable.
Selon le type, on distingue quatre classes de protéines conjuguées :
- Glycoprotéines (protéines avec des sucres)
- Lipoprotéines (protéines avec lipides)
- Phosphoprotéines (contiennent des groupes phosphoriques)
- Chromoprotéines (contiennent des métaux, par exemple de la chlorophylle qui contient du Mg, ou de l'hémoglobine qui contient du fer)
La description ci-dessus veut seulement expliquer, quoique brièvement, comment les protéines sont classées, afin de préciser que ces substances, au-delà de leur fonction athlétique destinée à "construire" les muscles, sont fondamentales pour la vie de tous les organes de notre corps. , chacun d'eux ayant une tâche spécifique.