Introducción
Editado por Dr. Gianfranco De Angelis
El término "proteína" ahora está muy extendido en todas partes y en todas partes escuchamos sobre suplementos de proteínas, proteínas en polvo, barras de proteínas, bebidas proteicas, etc. Sin embargo, pocos conocen su verdadero significado.
Por lo tanto, intentaré explicar qué proteínas no son desde un punto de vista bioquímico, sino resaltando su tipo de estructura y relación relativa. clasificación.
clasificación
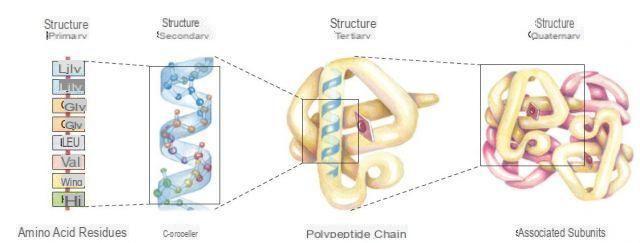
Clasificación de proteínas
- En función de la función realizada: enzimas, hormonas, transporte, almacenamiento y proteínas estructurales;
- Según la forma: proteínas fibrosas o globulares;
- Sobre una base química:
- proteínas simples: compuestas solo de aminoácidos
- Proteínas compuestas o conjugadas: se unen a otras moléculas (p. ej. azúcares, lípidos, ácidos nucleicos, metales, etc.).
sencillo
Hay dos clases de proteínas simples: fibrosas y globulares. La subdivisión se basa en la naturaleza de los aminoácidos que se obtienen con la hidrólisis de proteínas, por lo que su clasificación se basa en los conceptos de solubilidad y composición química.
Las proteínas simples dan lugar a ocho grupos de subdivisiones: protaminas, histonas, albúminas, globulinas, glutelinas, prolaminas, fosfoprótidas y escleroprótidas.
Protamina
Le protamina son proteínas bastante simples, ya que por escisión dan lugar a sólo unos pocos tipos de aminoácidos: principalmente arginina y lisina. Por tanto, tienen un peso molecular bajo.
Solubles en agua, de carácter fuertemente básico, las protaminas se encuentran en la naturaleza solo en el reino animal, combinadas con ácidos nucleicos para formar nucleoprótidos (especialmente en tejidos con función reproductiva, por ejemplo en los espermatozoides de muchos peces). No se encuentran libres en la naturaleza.
Las protaminas están libres de aminoácidos azufrados, triptófano y tirosina; en cambio, son muy ricos en aminoácidos básicos (en particular, arginina).
Istoni
Las istoni son prótidos bastante simples, aunque más complejos que las protaminas; como estas últimas, las histonas pertenecen únicamente al reino animal, tienen un carácter básico y son solubles en agua; en cambio, se distinguen por contener azufre y por originar cantidades menores de bases exónicas en la escisión (arginina, histidina y lisina), de las que, sin embargo, son ricas.
Al igual que las protaminas, las histonas no se encuentran libres en la naturaleza, sino que se combinan con otras sustancias para formar prótidos. Se encuentran en los glóbulos rojos, en los leucocitos, en la cabeza de los espermatozoides; la globina, que constituye el grupo proteico de la hemoglobina, es importante.
Albúmina
Le albúminas son las proteínas más conocidas y más accesibles; al estar muy extendidos, dieron su nombre a toda la clase de sustancias proteicas (sustancias albumoides). En el reino animal están muy extendidos y se asocian principalmente con globulinas, como constituyentes de células y secreciones celulares. Algunas de sus propiedades características son: solubilidad en agua, coagulabilidad con el calor y la posibilidad de dar lugar a todos los aminoácidos por escisión (son por tanto proteínas completas de buen valor biológico). Tienen un alto contenido de leucina (alrededor del 10-14%) y ácido glutámico (7-13%); también contienen buenas cantidades de arginina (6-10%) y lisina (6-8%).
Las principales albúmina animal son: ovoalbúmina (o albúmina de huevo) y albúmina de suero (o albúmina de leche). También se encuentran en muchas plantas, aunque sus propiedades no se conocen a la perfección. Una característica de la albúmina animal es tener un alto contenido de azufre, y un porcentaje considerable de aminoácidos cistina y metionina, mientras que los vegetales contienen cantidades modestas. Algunas albúminas vegetales son venenosas; este es el caso de la ricina en aceite de ricino.
Globulina
Le globulina son las proteínas más comunes, tanto en el reino animal como en el vegetal. Son muy similares, desde el punto de vista de la constitución molecular, a las albúminas, pero difieren en tamaño. Además, mientras que la albúmina se disuelve en agua, las globulinas no son polares; por otro lado, son solubles en soluciones salinas diluidas neutras (NaCl). Las más comunes son: globulinas sanguíneas (α β, γ), lactoglobulina (leche), ovoglobulina (huevos), miosina y mioglobina (músculo). Las globulinas vegetales se encuentran en particular en las semillas de muchas plantas, especialmente en las aceitosas de las leguminosas; muy ricas en globulinas son las proteínas de la soja y el maní, donde forman casi todas las sustancias proteicas. Si bien las globulinas animales no tienen deficiencias importantes en aminoácidos, las del mundo vegetal son muy deficientes en metionina (como era de esperar, el aminoácido limitante de la soja y otras legumbres).
Le Gluteline y prolamina (o gliadinas) representan dos grupos de proteínas exclusivamente vegetales, típicamente asociadas. Juntos, constituyen el mayor porcentaje de la reserva de proteínas de los cereales (90-95%).
Gluteline
Le glúteos tienen un equilibrio de aminoácidos justo y son muy ricos en ácido glutámico, aunque están presentes en concentraciones más bajas que las prolaminas. Son insolubles en agua, en soluciones salinas y en alcohol; se coagulan con el calor y son solubles en ácidos y bases diluidos. La glútea del trigo, llamada glutenina, forma un complejo proteico con la gliadina que constituye el gluten, indispensable para la panificación y en parte para la plastificación de las harinas. En el arroz, la gluteline presente se llama orizenine.
Prolamina o Gliadina
Le prolamina contienen, en cantidades considerables, el aminoácido prolina, del que deriva el nombre. Pertenecen únicamente al reino vegetal, de hecho, junto con la gluteline, constituyen la parte más importante de muchos cereales, de los que se extraen fácilmente. También se les llama gliadinas.
Las gliadinas más conocidas son: gliadina trigo, que dio su nombre a toda la clase: el orden de la cebada; el zein del maíz. Son insolubles en agua y solubles en alcohol al 60-80%. No se coagulan con el calor.
Las prolaminas son ricas en ácido glutámico, que representa el 20-30% de los aminoácidos de las semillas de los cereales; la prolina y la leucina también son abundantes, mientras que los aminoácidos azufrados, la lisina (que no es sorprendente el aminoácido limitante típico de los cereales) y el triptófano (deficiente en maíz) son escasos. Estas deficiencias de aminoácidos son responsables de la baja eficiencia proteica de los cereales. La intolerancia congénita a la gliadina se conoce como enfermedad celíaca.
Fosfoproteínas
I fosfoproteínas son proteínas particularmente ricas en ácido fosfórico, por tanto ricas en fósforo en forma de ácido ortofosfórico, unidas para esterificar el grupo alcohólico de los aminoácidos (como la serina). Tienen propiedades ácidas debido a los hidrógenos del ácido fosfórico que no participa en la esterificación. Las fosfoproteínas no deben considerarse proteínas conjugadas ni confundirse con nucleoproteínas capaces de hidrólisis del ácido fosfórico. Los fosfoprótidos están presentes principalmente en proteínas de origen animal, donde hay dos representantes importantes: las caseínas de la leche y la yema de la yema de huevo (la vitelina es una de las sustancias fundamentales de la yema y es una proteína particularmente rica en fósforo). También se recuerda la itulina de los huevos de pescado. Los principales constituyentes de estas proteínas son ácido glutámico (15-20%), serina (que abunda principalmente en proteínas de huevo), prolina (5-10%) y lisina (5-7%). Por otro lado, la cistina es escasa.
Scleroprotidi
Las scleroprotidi (o escleroproteína) también se llaman albuminoides o proteinoides y pertenecen escurridizamente al reino animal. A diferencia de las proteínas mencionadas anteriormente, no forman parte del protoplasma. Son sustancias con considerable resistencia química, insolubles en agua y disolventes comunes, que se disuelven solo en ácidos e incluso resisten la mayoría de las enzimas proteolíticas. En virtud de su excepcional resistencia química, realizan funciones mecánicas de recubrimiento, protección y soporte, mientras que tienen poco valor nutricional. Los escleroprótidos más importantes en los organismos animales son: colágeno (constituyente fundamental del tejido conjuntivo, cartilaginoso y óseo), elastina (constituyente básico de las fibras elásticas de tendones y paredes de vasos) y queratinas (constituyentes de uñas, cabello y cabello, pero también escamas , cuernos y plumas). Los escleropéptidos se componen de pocos aminoácidos: la cistina (por lo tanto azufre) abunda en queratina, mientras que el colágeno es rico en glicina (25%), prolina e hidroxiprolina, y deficiente en sulfuratos, triptófano y tirosina. La glicina y la leucina son abundantes en elastina, mientras que la cistina es escasa. La queratina no es atacada por los jugos gástricos, por lo que la digestibilidad y la absorción intestinal son muy bajas; deriva una escasa importancia en la alimentación. Hervir colágeno con ácidos diluidos aumenta su digestibilidad transformándolo en gelatina.
Proteínas conjugadas
Después de una breve descripción de los ocho grupos que subdividen las proteínas simples, es necesario hablar, aunque sea brevemente, de la segunda clase de proteínas, a saber, las proteínas proteínas conjugadas. Consisten en una simple prótesis unida químicamente a un grupo no proteico llamado prótesis. Los grupos protésicos son sustancias orgánicas naturales que actúan como cofactores enzimáticos (ayudantes). La parte proteica simple suele ser una proteína del grupo de las histonas o protaminas. El grupo protésico, por otro lado, es variable.
Según el tipo, se distinguen cuatro clases de proteínas conjugadas:
- Glicoproteínas (proteínas con azúcares)
- Lipoproteínas (proteínas con lípidos)
- Fosfoproteínas (contienen grupos fosfóricos)
- Cromoproteínas (contienen metales, por ejemplo, clorofila que contiene Mg o hemoglobina que contiene hierro)
La descripción anterior solo quiere explicar, aunque sea brevemente, cómo se clasifican las proteínas, para dejar claro que estas sustancias, más allá de su función atlética destinada a "construir" músculos, son fundamentales para la vida de todos los órganos de nuestro cuerpo. , cada uno de ellos con una tarea específica.